Journal of Pest Science. 2022
DOI : https://doi.org/10.1007/s10340-022-01557-6
微信公众号“岚瀚生命科学”
https://mp.weixin.qq.com/s/s4th0MrGT1epN2066A3-Uw
白纹伊蚊(Aedes albopictus)是登革热等蚊媒传染病(mosquito-borne diseases)的重要传播媒介[1],也是全球最具入侵性的蚊种[2]。媒介控制,特别是使用化学杀虫剂,是目前预防登革热的唯一有效途径。然而,杀虫剂的广泛和不当使用导致抗药性问题日益严重,尤其是对最常用的拟除虫菊酯类杀虫剂的抗药性,严重阻碍了登革热的防控[3, 4]。因此,确定白纹伊蚊种群对杀虫剂的抗药性水平对于病媒控制具有重要指导意义。了解白纹伊蚊抗药性产生和进化的分子机制,对研发精准敏感的抗药性检测分子方法至关重要。
目前公认的蚊虫对拟除虫菊酯杀虫剂(pyrethroid)的抗性机制主要包括影响杀虫剂结合亲和力的基因突变(target-site resistance,靶标抗性)和杀虫剂在达到靶标之前的代谢解毒作用(metabolic resistance,代谢抗性)。这些机制与杀虫剂抗药性的关联通常是基于现场研究的相关性分析,容易受到野外杀虫剂使用情况复杂、蚊虫种群的生活史和变化的环境条件等混杂因素的影响,验证这些特定机制和杀虫剂抗性之间的直接因果关系一直是一个挑战。科学家利用在非洲爪蟾卵母细胞成功表达的埃及伊蚊钠通道,为靶标基因突变导致拟除虫菊酯抗性提供了体外证据[5];近期也有科学家通过CRISPR/Cas9技术,在果蝇、甜菜夜蛾和冈比亚按蚊中体内验证了靶标基因突变对抗药性的直接贡献[6-8]。由于缺乏体内实验和因果证据,伊蚊的抗药性机制仍然不清楚。
2022年8月22日,南方医科大学热带医学研究所陈晓光教授等团队在国际学术期刊Journal of Pest Science上在线发表了题为“CRISPR/Cas9 mediated F1534S substitution in the voltage gated sodium channel reveals its necessity and sufficiency for deltamethrin resistance in Aedes albopictus”的文章。该研究利用CRISPR/Cas9技术在白纹伊蚊个体中证明了VGSC基因F1534S突变对溴氰菊酯抗性产生的关键作用,并建立了高效分子检测方法在野外种群中进行了验证,为白纹伊蚊抗药性监测管理提供了理论依据和实践应用。

作者选择最常用的拟除虫菊酯杀虫剂(pyrethroid)的代表性药物溴氰菊酯(deltamethrin)对实验室敏感品系(Lab-S)进行筛选,成功建立了一株白纹伊蚊溴氰菊酯抗性品系(Lab-R)。在持续施压的条件下,抗性发展的规律呈现出先缓后快的趋势(图1a, b),提示白纹伊蚊抗药性出现的早期是媒介控制的关键。在实验室筛选条件下,白纹伊蚊溴氰菊酯抗性产生初期,作为杀虫剂靶标的电压门控钠离子通道(voltage-gated sodium channels, VGSC)基因F1534S突变(target-site resistance,靶标抗性)首先出现,I1532T突变和代谢解毒酶的参与(metabolic resistance,代谢抗性)随后出现(图1c, d)。作者推测在白纹伊蚊溴氰菊酯抗性产生的过程中可能是先由VGSC等位基因F1534S突变引起,使种群的抗性程度不断发展。F1534S突变的出现并在种群内部达到一定频率是溴氰菊酯抗性产生的可能标志,因此,作者初步选择白纹伊蚊VGSC基因F1534S突变作为种群对溴氰菊酯产生抗性的分子标志,接下来进行功能验证。
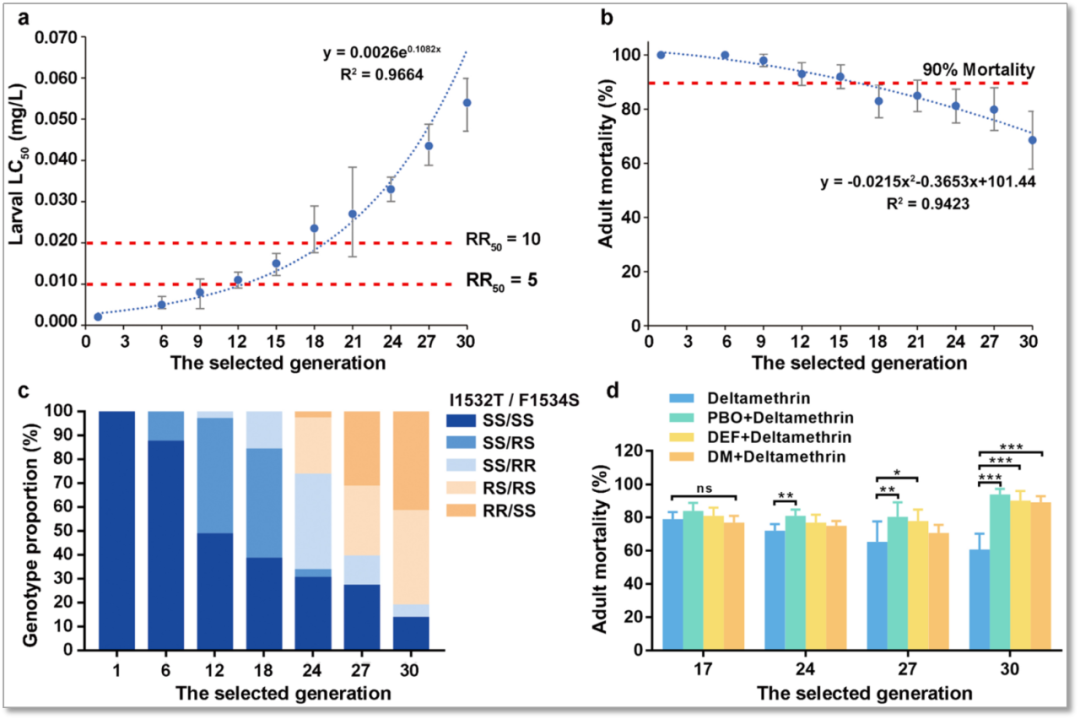
图1 白纹伊蚊对溴氰菊酯的抗性变化和抗性机制
从白纹伊蚊的敏感个体出发,作者利用CRISPR/Cas9技术成功构建了F1534S突变纯合品系(F1534S strain),该品系对溴氰菊酯杀虫剂具有高水平抗性(图2);通过与敏感品系回交恢复该突变(S1534F strain),可恢复种群对溴氰菊酯杀虫剂的敏感性(图2)。正反交获得的杂合子后代的生测结果表明F1534S杂合突变也可导致溴氰菊酯高度抗性。从1534S突变品系获得的溴氰菊酯抗性为常染色体遗传,接近完全显性遗传。
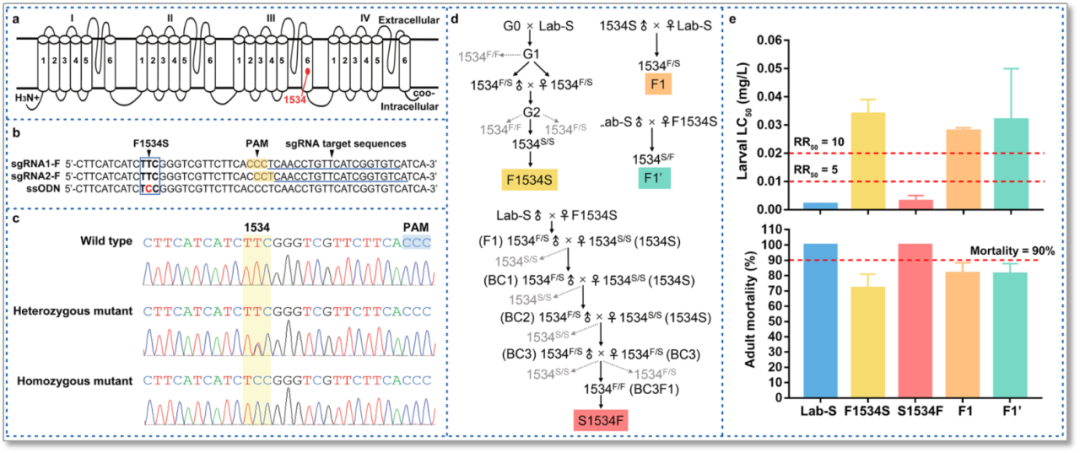
图2 Cas9/gRNA介导的F1534S突变与白纹伊蚊相关品系的抗药性
通过白纹伊蚊VGSC基因F1534S突变对蛋白构象的影响预测和对接分析发现,突变前后的预测蛋白构象相似(图3a, b),但突变后的蛋白与溴氰菊酯分子结合力较低(图3c)。对几个相关品系的VGSC基因表达量进行检测,发现白纹伊蚊幼虫期的VGSC基因表达量都显著低于成蚊期(图3d),且溴氰菊酯抗性品系的表达量均低于敏感品系(图3e)。以上结果说明白纹伊蚊不仅通过钠离子通道位点的突变改变与杀虫剂的结合力,还可能通过改变VGSC基因的表达量来降低对杀虫剂的敏感性。
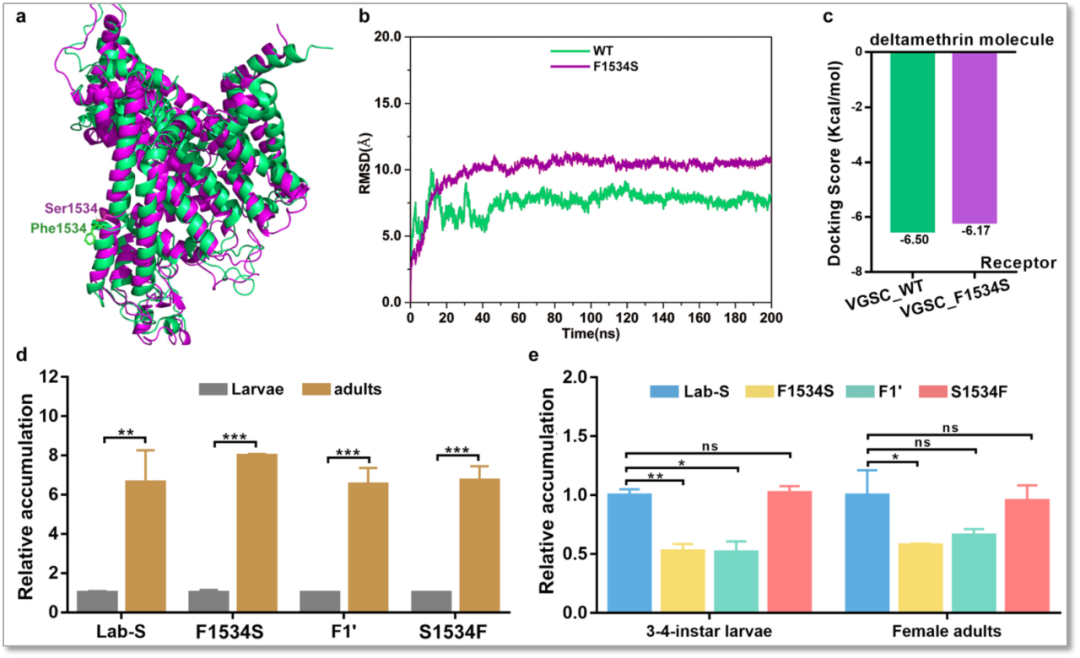
图3 F1534S突变引起的VGSC蛋白结构变化和表达量变化
进一步作者对收集的14个白纹伊蚊种群对溴氰菊酯的抗药性和VGSC基因1534位点进行检测。3个实验室敏感品系和1个野外敏感种群的VGSC基因1534位点均未检测到突变,而其余10个对溴氰菊酯抗性的野外种群均检测到F1534S突变(图4)。这些结果显示,检测到VGSC基因F1534S突变可以作为白纹伊蚊种群对溴氰菊酯产生抗性的分子依据之一。基于以上的结果,作者建立了白纹伊蚊VGSC基因F1534S突变的AS-PCR方法,以达到快速检测野外白纹伊蚊种群F1534S突变频率并评估溴氰菊酯抗性的目的。
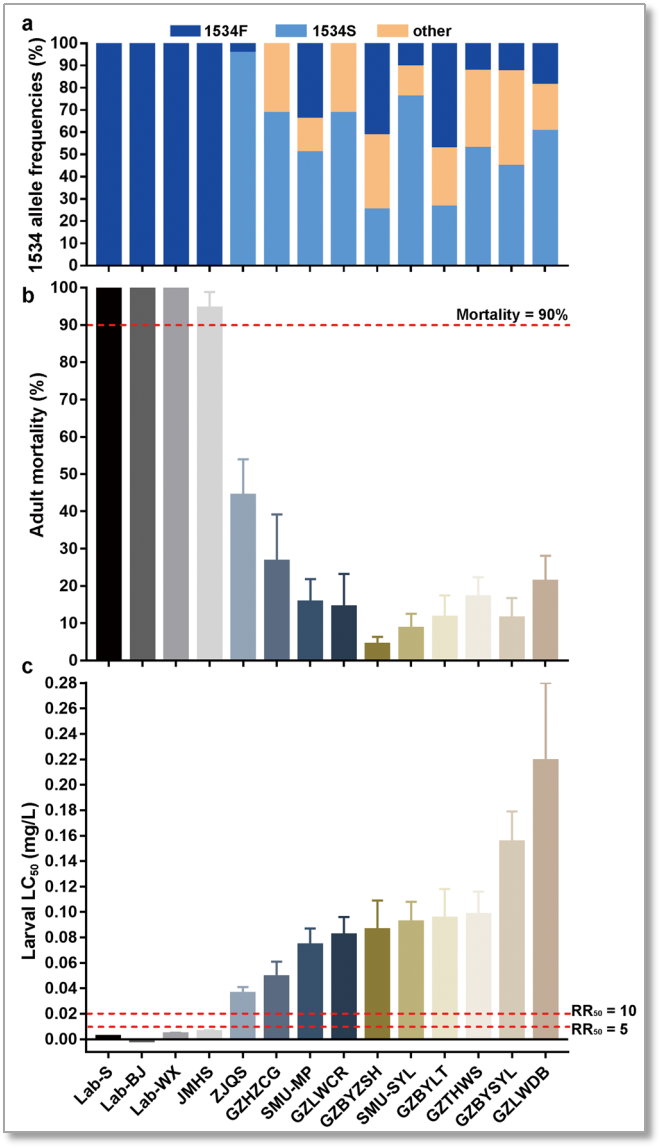
图4 白纹伊蚊实验室品系和野外种群的溴氰菊酯抗性和1534位点突变
综上所述,该研究发现白纹伊蚊暴露于溴氰菊酯过程中发生的VGSC基因F1534S突变是白纹伊蚊种群对溴氰菊酯产生抗性的关键,并首次利用CRISPR/Cas9技术在白纹伊蚊个体对VGSC基因F1534S突变进行了功能分析,发现该突变可能通过改变蛋白与溴氰菊酯的亲和力和表达水平赋予种群高水平的溴氰菊酯抗性。在实验室功能验证和野外种群检测的基础上,开发了一种用于白纹伊蚊种群对溴氰菊酯抗药性监测的诊断性分子检测方法,可作为病媒抗药性筛选的依据。这些结果支持了白纹伊蚊对溴氰菊酯抗性进化过程中靶标抗性起着重要作用的结论,值得注意的是,这一现象虽然在实验室品系和多个野外种群,以及野外调查研究中得到支持,但由于野外蚊媒的不同遗传背景、杀虫剂使用情况不同和复杂的环境等因素,蚊媒对杀虫剂抗性产生的分子机制的广谱性需要更多的样本和研究去进一步验证。
Insecticide resistance in Aedes mosquitoes presents a major challenge to the control of arboviral diseases. However, resistance mechanisms for many of the insecticides remain unknown. A commonly used insecticide, deltamethrin, was used to select a resistance strain of the vector mosquito, Aedes albopictus, and we identified an F1534S substitution in the voltage-gated sodium channel (VGSC) gene product as the first event in generating resistance. Engineering an F1534S substitution using Cas9/gRNA technologies conferred deltamethrin resistance on a previously susceptible strain. Crosses that removed this mutation restored the susceptible phenotype. Predicted protein structural changes and differences in transcript accumulation levels were correlated with the resistance phenotype. Furthermore, F1534S mutations were detected in all resistant Ae. albopictus populations collected in the field. We conclude that the VGSC F1534S mutation is essential for resistance to deltamethrin in Ae. albopictus, and is a suitable molecular index for pyrethroid resistance detection and monitoring in this species.