近日,国家自然科学基金委员会官方网站报道了我校白晓春、宋千成研究团队在神经调控骨形成的机制方面取得进展,研究团队发现了颅脑损伤后神经调控骨形成的机制,研究成果以“受损后大脑通过释放靶向骨祖细胞的小细胞外囊泡加速骨愈合(Damaged Brain Accelerates Bone Healing by Releasing Small Extracellular Vesicles that Target Osteoprogenitors)”为题,于2021年10月15日在线发表于《自然•通讯》(Nature Communications),该研究受国家自然科学基金项目(批准号:81991510、81625015)等资助。
颅脑损伤常见于交通事故、高处坠落、失足跌倒等,其发生的同时往往伴随着机体骨折。临床研究发现,颅脑损伤合并骨折患者较单纯骨折患者,其骨痂生长更多、更快,骨折愈合时间更短,但机制不明。骨延迟愈合、骨不连是临床上骨折致残的主要原因,大约10%的骨折患者由于骨再生不足导致骨不连。目前,临床上缺乏骨愈合延迟或骨不连的治疗药物,如能阐明颅脑损伤促进骨形成的分子机制,可能为骨延迟愈合、骨不连的治疗提供思路。
该研究团队针对颅脑损伤加速骨折愈合这一临床现象展开系统研究,首先收集了相关患者的临床标本,并构建了颅脑损伤合并骨折的动物模型。随后的研究发现,颅脑损伤患者与动物血浆中的小细胞外囊泡(small extracellular vesicles, sEVs)含量显著升高,囊泡内富含miR-328a-3p和miR-150-5p,这两种miRNA可分别抑制FOXO4和CBL蛋白的转录,从而促进骨的形成。该研究团队利用蛋白组学,发现sEVs中的A2M蛋白含量升高,它是神经元损伤的一种相关蛋白,提示颅脑损伤患者与动物血浆中升高的sEVs可能来自受损的神经元。进一步研究发现,海马神经元在颅脑损伤后可释放出富含上述具有成骨功能miRNA的sEVs。并且,sEVs膜表面的纤连蛋白(Fibronectin 1,FN1)表达明显升高,使用FN1的抑制剂可以阻断sEVs在骨折处富集,提示FN1可能是脑源性sEVs靶向骨组织的关键蛋白。该研究团队还将miR-328a-3p电转至sEVs,并包埋至水凝胶,应用于骨缺损的动物模型,结果显示可加速骨修复,对难以愈合的颅骨缺损也具有显著疗效(图1)。
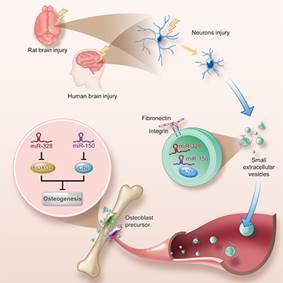
图1 颅脑损伤情况下受损神经对骨愈合的调控机制模式图
该研究揭示了颅脑损伤后神经对骨形成的调控机制,即受损的神经细胞释放富含具有促进成骨功能miRNA的sEVs,这些sEVs通过FN1靶向至骨组织并释放miRNA作用于成骨前体细胞,从而促进骨形成。该研究也为骨延迟愈合、骨不连等临床问题提供了新的治疗思路。










